|
|
… href="http://ru.wikisource.org/w/index.php?title=%D0%A4%D0%B0%D0%B9%D0%BB:Brockhaus_and_Efron_Encyclopedic_Dictionary_b11_195-0.jpg&filetimestamp=20090706143926">  Стальные стенки ее D и притертая крышка ЕЕ выложены внутри платиной для устранения химического действия на них продуктов горения. Крышка прижимается с помощью гайки FF; через стальной придаток А проходит винтовой кран CB для запора и выпускания газов. Воспламенение заряда производится, накаливая током проволоку f, прикрепленную между изолированным конусом M и штифтом, ввинченным в крышку. При самом измерении, кроме обыкновенных калориметрических предосторожностей, нужно обратить внимание главным образом на то, что вследствие значительной толщины стенок бомбы передача тепла от продуктов горения калориметру происходит и после того, как получился максимум температуры, т. е. для вычисления поправок на охлаждение калориметра необходимо к концу наблюдений дождаться равномерности. Но при современном богатстве числовых данных относительно теплот образования из элементов разнообразных химических соединений (см. Термохимия) возможно получить точные величины теплот разложения В. веществ и помимо прямых измерений, пользуясь только термохимическими таблицами — во всех случаях, когда точно известны уравнения их разложения. Напр., зная, что при взрыве двух граммовых частиц нитроглицерина образуются: 6CO2 + 5H2O + 3N2 + 0,5O2, по этим таблицам находим, что теплоты образования из элементов каждой граммовой частицы сложных продуктов: СО2 из алмаза и кислорода = +94 Кал., Н2О жидкой из водорода и кислорода = +68,8 Кал., Н2О газообразной = +58,2 Кал., а теплота образования из элементов свободных простых тел (по условию) равна нулю, откуда для данных количеств этих газов получится сумма 6 x 94 + 5 x 68,8 Кал. (при жидкой воде), или 6 x 94 + 5 x 58,2 Кал. (при газообразной воде). Простые тела, входя в соединение между собой, при образовании каждой граммовой частицы нитроглицерина теряют часть своей энергии в виде тепла, а именно +98 Калор., как находим в тех же термохимических таблицах, и потому при дальнейшем превращении в CO2, Н2О, N2, и О2 (т. е. при взрыве) по закону сохранения энергии должны отделить на это количество меньше тепла. Очевидно, уменьшая выше найденную сумму на 2 x 98, мы и получим теплоту разложения 2 граммовых частиц нитроглицерина. Относя результаты к 1 килограмму, окончательно найдем 1570 Кал. (при воде жидкой) и 1458 Кал. (при воде газообраз.). Следовательно, вообще теплота разложения какого-либо взрывчатого вещества равняется сумме теплот образования из элементов продуктов взрыва без теплоты образования из элементов его самого. Отличают теплоты разложения взрывчатых веществ при постоянном давлении qp и при постоянном объеме Qv, притом считая воду и подобные продукты то в жидком, то в газообразном состоянии. По термохимическим таблицам находятся собственно Qp, опытом же в калориметрической бомбе определяются Qv, считая воду жидкой, что нужно иметь в виду при сравнении опытных данных с вычисленными. Однако известным образом можно перейти от Qp к Qv и обратно, зная объем газов. Беря тот же пример нитроглицерина, для которого Сарро и Вьейль опытно нашли Qv = +1600 Кал., представим себе вертикальный прямоугольный параллелепипед с площадью поперечного сечения в 1 кв. дециметр и в нем поршень, на который давит 1 атмосфера, или, другими словами, — груз в 103,33 килограмма. Если, удерживая поршень на расстоянии 1 дециметра от дна, взорвем под ним 1 килограмм нитроглицерина, то газы, занимающие при нормальных условиях объем в 713 литров (при газообразной воде), или 467 литр. (при жидкой воде), поднимут поршень с грузом на высоту 71,3 или 46,7 метров, т. е. произведут работу, равную 103,33 x 71,3, или 103,33 x 46,7 килограммометров. На эту же работу затратится определенное количество тепла q, а именно (103,33 x 71,3)/424 = 17 Кал., или (103,33 + 46,7)/424 = 11 Кал.; между тем как если бы поршень был удержан в своем первоначальном положении, то внешняя работа не была бы произведена и вся затраченная на нее теплота осталась бы в газах. Следовательно, вообще Qp меньше Qv на q и в частности для нитроглицерина Qv (при жидкой воде) равно Qр x q = 1570 + 11 = 1581 Кал., что уже близко подходит к величине, найденной Сарро и Вьейлем. Опытные измерения теплот разложения являются особенно необходимыми во всех случаях, когда уравнения разложения с какой-либо стороны остаются неопределенными. В следующей таблице даны Qp и Qv для тех же В. веществ, для которых выше были приведены V0.
Указанным способом находятся количества тепла, отделяемого В. веществами при условии отсутствия каких-либо внешних работ, произведенных во время взрыва; если же последние производятся, как это бывает при практических применениях, то вследствие затраты на них части тепла его отделяется меньше. Тогда нахождение остающегося количества теплоты приводится к определению действительных произведенных взрывами работ (см. ниже, работа В. веществ). VII. Температура, развиваемая взрывчатыми веществами, до сих пор представляет непреоборимые затруднения для непосредственного измерения. Доныне известно лишь то, что температура, получающаяся при взрыве обыкновенного пороха, лежит выше температуры плавления платины (1800°). Остается поэтому определять температ. вычислением на основании известного соотношения между температурой t, теплотой, ей сообщаемой, Q и теплоемкостью с по формуле В недавнее время, с одной стороны, Малляр и Ле Шателье («Recherches expérimentales et théoretiques sur la combustion des mélanges gazeus explosifs», Париж, 1883), с другой — Бертело и Вьейль («An. de Chimie et de Phys.», 6-e série, t. 4, p. 13) подвергли изучению температуры, получающиеся при горении взрывчатых газовых смесей в бомбах, измеряя давления продуктов горения, т. е. произвели приближенную оценку этих температур по шкале воздушного термометра. Очевидно, деля количества тепла при постоянном объеме, соответствующие горению смесей, на найденные температуры, получим средние теплоемкости продуктов взрыва при постоянном объеме между пределами от 0° до этих температур, если только при взрыве не было диссоциации. Более точными являются результаты, принадлежащие Малляру и Ле Шателье, так как, разбавляя смеси инертными газами, эти авторы избегали получения особенно высоких температур, при которых можно было ожидать диссоциации Н2О и СО2, между тем как Бертело и Вьейль не прибегали к подобному приему. Если возьмем так называемые частичные теплоемкости, т. е. произведения средних теплоемкостей, отнесенных к 1 гр., на частичные веса соответствующих газов, то оказывается — они растут с температурой по формуле cv = а + bt, где а и b постоянные зависящие от состава газа, а именно:
Хотя температуры в опытах Малляра и Ле Шателье не шли выше 2500°, однако, предполагая, что найденные формулы для сv прилагаются и при дальнейшем нагревании, авторы нашли возможным вычислить температуры горения важнейших В. веществ («Mémoriales des poudres et salpêtres», t. II, p.) по формуле
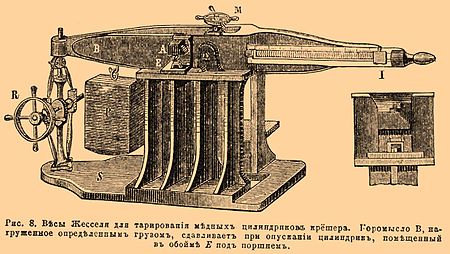
и др. Очевидно, наиболее высокие температуры получаются для нитроглицерина и нитроманнита вследствие наибольших количеств тепла, отделяющегося при их взрыве. Главное замечание, которое можно здесь сделать, состоит в том, что неизвестно в действительности, применяются ли вышеуказанные формулы теплоемкостей выше пределов температур, при которых они найдены. Хотя Бертело и Вьейль, имевшие в своих опытах над газами температуры до 4000°, подтверждают факт продолжающегося возрастания теплоемкостей, но полученные ими числа при столь высоком нагревании суть кажущиеся теплоемкости, т. е. представляют средние количества тепла, идущего не только на нагревание, но и на диссоциацию. Кроме того, при взрыве газовых смесей вследствие незначительности их массы на давление должно оказывать влияние охлаждения стенками бомбы, а это необходимо скажется на величинах вычисляемых теплоемкостей[3]. VIII. Давление (сила), развиваемое при взрыве, есть результат превращения вещества в газы и нагревания последних до возвышенной температуры. Оно определяется не только объемом газов и температурой их, но также отношением веса взятого вещества к объему зарядной камеры, или т. н. плотностью заряжания. Наибольшая величина его при невысоких плотностях заряжания может быть измерена или непосредственно, или найдена вычислением. Непосредственное измерение давлений, как вообще всякой силы, осуществляется двумя приемами: статически, т. е. приискав силу, уравновешивающую давление продуктов разложения, или динамически, т. е. определив закон движения, сообщенного какому- либо весомому телу. Самый первый способ измерения был дан Румфордом в 1792 году, который, производя взрывы обыкновенного пороха в укороченной небольшой пушке, поставленной вертикально, подыскивал груз, уравновешивающий давление газов. Отсылая для более близкого знакомства как с этим способом, так и со многими другими, сюда относящимися, к специальным сочинениям («Traité sur la poudre etc.» par Upmann et Meyer, ouvrage, traduit par Desortiaux), упомянем здесь только о более важных. Из основанных на статическом приеме в настоящее время применяются: 1) способ Родмана (1857 г.), в котором о величине давления судят по размерам углубления, производимого в плитке из красной меди посредством пирамидального стального ножа, приделанного к поршню, передающему действие газов; 2) крешер Нобля (1868 г.), позволяющий выводить давление газов, передаваемое также через поршень, из сжатия небольшого медного цилиндрика. Между динамическими более примечательны способы Марсель-Депре, предложившего: 1) акселерометр, т. е. измеритель начальных скоростей поршня, подверженного действию газов; 2) акселерограф, в котором закон движения поршня выводится из кривой, получаемой на закопченной пластинке, к нему прикрепленной. Остановимся ближе только на измерениях с помощью крешера. Опыты производятся в манометрической бомбе. Она представляет толстостенную трубку из мягкой стали, скрепленную снаружи другой такой же трубкой, и снабжена на открытых концах внутренними винтовыми нарезами для ввинчивания укупоривающих пробок, одной — с крешером, другой с приспособлением для воспламенения (рис. 2 и 4). С помощью гальванического тока накаливают тонкую железную или платиновую нить, натянутую между штифтами, из которых один прикреплен к пробке, а другой к конусу, пригнанному точно к каналу и изолированному с помощью полоски животного пергамента или посредством тонкого слоя лака; при взрыве конус с силой вдавливается в канал и не допускает ни малейшего выхода газов. Но газы могли бы выходить через винтовые нарезы между пробками и стенками бомбы; для предупреждения этого под обеими пробками помещаются кольцеобразные медные обтюраторы, пригнанные к каналу бомбы, в этих местах немного сточенному, так что пробки могут прижиматься к обтюраторам, а взрывом они еще плотнее придавливаются друг к другу. В такой бомбе безопасно можно измерять давления, не превосходящие 4000 килогр. на 1 кв. сантиметр. Крешер приспособляют к одной из пробок (см. рис. 6). В канале пробки двигается хорошо пришлифованный, из закаленной стали, поршень а с определенным сечением, напр. 1 кв. сант.; для лучшего устранения прорыва газов на конце его, обращенном внутрь бомбы, делаются круговые канальцы b, смазываемые салом; кроме того, накладывается медный обтюратор f. Поршень под влиянием газов давит непосредственно на медный цилиндрик γ в 13 мм высотой и 8 мм диаметром, установленный посредине с помощью каучукового кружка ее и другим своим основанием упирающийся в стальной винт d. Самую существенную часть прибора составляет этот медный цилиндрик, который, соответственно давлению, сжимается на известную величину. Фиг. 7 представляет формы его в различных степенях обжатия. Эти цилиндрики обыкновенно заготавливаются сразу в большом количестве; из однородных полос чистой меди и подвергаются предварительному отжиганию. Хорошо приготовленные образцы сжимаются совершенно правильно; основания при сжатии всегда сохраняют форму правильного круга, а боковая поверхность остается гладкой. Для пользования цилиндриками составляется опытным путем таблица, показывающая зависимость между сжатиями их и соответствующими давлениями. Рациональный метод для составления таких таблиц был указан только в недавнее время (1883 г.) Сарро и Вьейлем, которые обстоятельными опытами констатировали, что сжатие цилиндрика крешера при данной сжимающей силе зависит от того, будет ли эта сила приложена сразу или будет возрастать постепенно от нуля до определенной величины, и, кроме того, от веса поршня, через который передается давление. При составлении таблицы Сарро и Вьейль пользовались весами Жесселя (см. рис. 8). Через коромысло В, опирающееся своим ножом на верхушку массивной чугунной подставки, проходит длинный стержень, половины которого снабжены винтовыми нарезками в обратном направлении, так что при поворачивании винта М с одной стороны указатель J, с другой — груз P двигаются одновременно то к концам, то к середине коромысла. К одному из концов приспособлен параллелограмм, с помощью которого, вращая колесо R, можно более или менее быстро опускать коромысло с грузом. Сдавливание производится с помощью зубца А: цилиндрик ставится на столик, приделанный спереди, под стальным поршнем, движущимся внутри обоймы E и принимающим давление зубца А. Непосредственный опыт убеждает, что если некоторая сжимающая сила Т килогр. сразу приложена к медному цилиндрику, так что она остается постоянной во все время обжимания, то полное сжатие ε мм получится вдвое более, нежели в том случае, когда сила, возрастая от нуля, постепенно достигнет той же величины Т. Таблица составляется при медленном нарастании давлений. С этой целью, по Сарро и Вьейлю, наиболее удобно поступать следующим образом: поставив груз P так, чтобы на поршень обоймы Е получалось требуемое давление Т, и поместив цилиндрик под поршень, с помощью параллелограмма доводят коромысло до прикосновения зубца А с поршнем; затем, медленно вращая колесо R, начинают сжатие до тех пор, пока коромысло, опускающееся вместе с верхней частью параллелограмма, не начнет отставать от последнего, что легко подметить, помещая между ними полоску тонкой бумаги в натянутом положении; в этот момент быстро дают колесу обратное вращение. Так как высота цилиндриков всегда = 13 мм, то, измерив остаточную высоту h с точностью до 0,01 мм, находят разность 13 — h, которая и представляет искомое сжатие ε, соответствующее постепенно нарастающей силе Т. При таком способе тарирования оказалось, что между пределами от 1000 до 3500 килограммов зависимость Т и ε выражается функцией Т = К0 + Кε, где К0 и К постоянные, очень мало изменяющиеся для различных партий цилиндриков, тщательно сделанных: Кс = 541 и К = 535.
Величины Т, очевидно, представляют сопротивления цилиндриков в разных степенях сжатия при данном способе тарирования. Пусть в манометрической бомбе произведен какой-нибудь взрыв. Если бы давление газов P нарастало медленно, так что оно постоянно уравновешивалось сопротивлением цилиндрика крешера, то зависимость P от сжатия ε выразилась бы такой же линейной функцией, как зависимость между Т и ε, и тогда P на всю площадь основания поршня было бы равно Т. Но такое постоянное равновесие существовало бы во всех случаях только тогда, когда давления передавались бы цилиндрику непосредственно; при передаче же этих давлений через поршень вследствие инерции последнего, вообще говоря, в начале взрыва сопротивление цилиндрика выходит менее, нежели давление газов, а к концу взрыва оно увеличивается, и сжатие прекращается, когда полная работа давления газов будет равна работе сопротивления цилиндрика. Изображая (см. рис. 9) найденную выше зависимость между Т и ε графически прямой линией CF, давления газов во время сжатия, вследствие быстрого возрастания их до максимума по другому закону, нужно выразить кривой ОР, обращенной своей вогнутой стороной к оси абсцисс. Так как, согласно вышесказанному, вначале кривая давлений P идет выше линии Т, то вследствие равенства окончательных работ их в последующие периоды сжатия кривая P должна идти ниже Т. Следовательно, при употреблении поршней между Т и P существует только некоторое соотношение, определяемое быстротой возрастания давления и массой поршней. Чем медленнее совершается разложение взрывчатого вещества и чем меньше масса поршня, тем ближе значения Т и P к совпадению и тем меньше отличаются друг от друга обе эти величины, оцениваемые по окончательному сжатию. Наоборот, чем быстрее разложение и чем больше масса поршня, тем выше вначале располагается линия P над линией Т, тем выше идет последняя над первой к концу и, следовательно, тем больше отношение Т/Р. Но пусть имеем крайний случай, когда разложение почти мгновенно и давление газов сразу достигает некоторой величины P, остающейся постоянной во все время сжатия. Тогда соотношение между Т и P выразится графически чертежом (см. рис. 10). Из равенства площадей oacdef и oabcef, выражающих работы, следует, что треугольники abc и ecd равны, т. е. ab = ed и bc = се. Следовательно, of = 2og, и потому в данном случае сопротивление Т, равное df, соответствует сжатию of, вдвое большему, чем сжатие og, соответствующее действительному давлению P, равному cg (при предположении медленного его возрастания). Таким образом, имеем два крайних случая: 1) давление возрастает медленно — тогда оно непосредственно находится по таблице для Т; 2) давление возрастает столь быстро, что его можно считать постоянным во все время сжатия, — тогда оно равно величине Т, соответствующей вдвое меньшему сжатию, чем наблюденное. Очевидно, при измерениях давлений какого-либо взрывчатого вещества нужно знать, какой из этих двух крайних случаев к нему применяется или имеет место еще некоторый средний случай. Для этого необходимо знать соотношение между быстротой развития максимума давлений τ для взятого взрывчатого вещества и промежутком времени τ0, необходимым для получения сжатия под действием данной постоянной силы, приложенной к цилиндрику без начальной скорости поршня. В самом деле, если последний промежуток τ0 будет значительно менее первого τ (в два раза и более), то, понятно, ни в начале, ни к концу сжатия линия P не отклонится от линии Т, так как тогда поршень, производя сжатие, во всяком случае будет успевать повиноваться давлению газов. Наоборот, если τ сравнительно с τ0 так мало, что его можно считать равным нулю, то это значит, что сжатие производится как бы постоянной силой. Для определения промежутка времени τ0 Сарро и Вьейль, составляя уравнение движения поршня, сжимающего цилиндрик под действием постоянной силы, получили окончательно выражение: Производя такие определения с поршнем около 60 гр., были найдены следующие результаты. Для обыкновенного пороха в различной степени его измельчения отношение Следующая таблица содержит в себе данные для трех приведенных взрывчатых веществ (площадь основания поршня 1 кв. сан.):
Давления, отвечающие более высоким плотностям заряжания, находятся вычислением, определяя закон их изменения при малых плотностях, допускающих опыты в бомбах. Если взрывчатое вещество сполна превращается в газы, то отношение
Откуда, изменение Нахождение давлений вычислением предполагает, что состав газов при максимуме температуры тот же, как и после охлаждения; что температура их вычислена близко к действительности и, наконец, что законы изменения их упругости с плотностью и температурой известны. Пусть 1 килогр. газов занимает при нормальных условиях V0 литров, и положим, что мы заключили их в камере объема v литров и сообщили температуру t°. Если бы они были идеальные газы, т. е. строго повиновались законам Мариотта и Гей-Люссака, то давление их равнялось бы P = (V0/v)[(273 + t)/273]; означая V0/273 через R, (273 + t) — через Т (абсолют. темпер.), 1/v через Δ (плотность газов), это выражение принимает вид P = RTΔ. В применении к килограмму взрывчатого вещества, сполна превращающегося в газы, R и Т суть постоянные для него, Δ же — плотность заряжания. Но действительные газы не следуют строго законам Мариотта и Гей-Люссака, так как они представляют системы материальных частиц, занимающих известный объем и претерпевающих некоторое взаимное притяжение, притом — величины этого объема и притяжения для различных газов неодинаковы. Принимая во внимание оба приведенные фактора и выражая давление в килогр. на 1 кв. сант., Ван-дер-Ваальс вывел следующее уравнение: RT = (р + a/v2)(v — b), в котором величина а характеризует меру притяжения газовых частиц (она обратно пропорциональна квадрату емкости камеры), b служит мерой объема их. Клаузиус заменил это уравнение другим, более точным и в то же время более удобным для вычисления давлений: P = RT/(v — b) — a/Т(с + d)2, в котором значения а и b те же самые, но а принимается изменяющимся обратно пропорционально Т и квадрату суммы с + d, представляющих новые две постоянные. Оба члена уравнения Клаузиуса применяются лишь при очень точных вычислениях; для приближенных же вычислений давлений, развиваемых взрывчатыми веществами, достаточно пользоваться упрощенным выражением Р = rt/(v — b), т. к. вторым членом, по его сравнительно малой |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
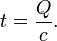 Но, принимая Q те же, какие соответствуют продуктам после охлаждения, а с тождественными с известными для температур, недалеких от обыкновенной, по этой формуле вычисляются t, весьма отдаленные от действительных температур. Причина неточности подобных расчетов, главным образом, заключается в изменении теплоемкости с температурой, так как неполным тождеством продуктов взрыва при максимуме температуры и после охлаждения и связанной с этим некоторой неопределенностью в количестве тепла, участвующего в нагревании, можно пренебречь.
Но, принимая Q те же, какие соответствуют продуктам после охлаждения, а с тождественными с известными для температур, недалеких от обыкновенной, по этой формуле вычисляются t, весьма отдаленные от действительных температур. Причина неточности подобных расчетов, главным образом, заключается в изменении теплоемкости с температурой, так как неполным тождеством продуктов взрыва при максимуме температуры и после охлаждения и связанной с этим некоторой неопределенностью в количестве тепла, участвующего в нагревании, можно пренебречь. причем Q’v выражено в малых калориях и отнесено к граммовой частице вещества (при газообразной воде), а постоянные а и b для смеси газов, состоящих вообще из αСО2, βH2O и λ(CO, N2, H2, O2), определены из равенств: а = 6,26α + 5,61β + 4,8λ и b = 0,0037α + 0,0033β + 0,0006λ.
причем Q’v выражено в малых калориях и отнесено к граммовой частице вещества (при газообразной воде), а постоянные а и b для смеси газов, состоящих вообще из αСО2, βH2O и λ(CO, N2, H2, O2), определены из равенств: а = 6,26α + 5,61β + 4,8λ и b = 0,0037α + 0,0033β + 0,0006λ.



 т. е. это время не зависит от величины сжимающей постоянной силы, а лишь от массы поршня и величины коэффициента k в функции, показывающей зависимость между Т и ε (или от свойств взятых цилиндриков). Так, при поршне весом в 60 гр. (чаще всего применяемом) и значении К = 535, беря ускорение силы тяжести 9810 мм, вычисляется τ0 = 0,00034 секунды. Что же касается времени τ, в течение которого нарастает максимум давления для взятого взрывчатого вещества, то оно выводится из быстроты сжатия цилиндрика θ, находимой по способу, описанному при рассмотрении скорости горения взрывчатых веществ. Когда отношение θ/τ0 более 2, Сарро и Вьейль принимают τ = θ; если же θ/τ0 менее 2, то приближенно τ = 2(θ — τ0).
т. е. это время не зависит от величины сжимающей постоянной силы, а лишь от массы поршня и величины коэффициента k в функции, показывающей зависимость между Т и ε (или от свойств взятых цилиндриков). Так, при поршне весом в 60 гр. (чаще всего применяемом) и значении К = 535, беря ускорение силы тяжести 9810 мм, вычисляется τ0 = 0,00034 секунды. Что же касается времени τ, в течение которого нарастает максимум давления для взятого взрывчатого вещества, то оно выводится из быстроты сжатия цилиндрика θ, находимой по способу, описанному при рассмотрении скорости горения взрывчатых веществ. Когда отношение θ/τ0 более 2, Сарро и Вьейль принимают τ = θ; если же θ/τ0 менее 2, то приближенно τ = 2(θ — τ0). всегда более 2, и потому давления его при различных плотностях заряжания равны Т, соответствующим полному сжатию цилиндриков. Для пироксилина
всегда более 2, и потому давления его при различных плотностях заряжания равны Т, соответствующим полному сжатию цилиндриков. Для пироксилина  т. е. близко к нулю, и следовательно, давление тогда равно Т, соответствующему 1/2 ε. И действительно, при одной и той же плотности заряжания (0,3) с малым поршнем получается сжатие 3,50, а с большим 6,50, т. е. почти вдвое большее.
т. е. близко к нулю, и следовательно, давление тогда равно Т, соответствующему 1/2 ε. И действительно, при одной и той же плотности заряжания (0,3) с малым поршнем получается сжатие 3,50, а с большим 6,50, т. е. почти вдвое большее.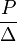 (где Δ — плотность заряжания) чувствительно представляет линейную функцию:
(где Δ — плотность заряжания) чувствительно представляет линейную функцию:  где f и b постоянные. Такая же зависимость замечается и для веществ, дающих при взрыве твердые нелетучие продукты; нужно только при расчете плотности заряжания вместо отношения между весом заряда и объемом камеры взять отношение части заряда, соответствующей газам, к емкости камеры, уменьшенной на объем твердых продуктов. Очевидно, вопрос сводится к измерению давлений при нескольких постепенно возрастающих Δ. Возьмем, напр., пироксилин. Сарро и Вьейль для него получили следующие данные:
где f и b постоянные. Такая же зависимость замечается и для веществ, дающих при взрыве твердые нелетучие продукты; нужно только при расчете плотности заряжания вместо отношения между весом заряда и объемом камеры взять отношение части заряда, соответствующей газам, к емкости камеры, уменьшенной на объем твердых продуктов. Очевидно, вопрос сводится к измерению давлений при нескольких постепенно возрастающих Δ. Возьмем, напр., пироксилин. Сарро и Вьейль для него получили следующие данные: по которому можно вычислить Р и при больших плотностях заряжания; напр., при Δ = 1,00 (для прессованного вещества) Р = 15700 килограммов на 1 квадратный сантиметр. Но легко видеть, что вычисляемые таким образом давления при больших плотностях заряжания будут только более или менее приближаться к действительным, так как величина их при значительных Δ в сильной степени зависит от величины коэффициента b (т. е. наклона прямой к осям координат), который, в свою очередь, определяется точностью самих опытных данных
по которому можно вычислить Р и при больших плотностях заряжания; напр., при Δ = 1,00 (для прессованного вещества) Р = 15700 килограммов на 1 квадратный сантиметр. Но легко видеть, что вычисляемые таким образом давления при больших плотностях заряжания будут только более или менее приближаться к действительным, так как величина их при значительных Δ в сильной степени зависит от величины коэффициента b (т. е. наклона прямой к осям координат), который, в свою очередь, определяется точностью самих опытных данных