hocheshzitvmire.narod.ru |
готовься к войне |
|
|
Взрывчатые вещества — будучи при обыкновенных условиях более или менее постоянны, под влиянием накаливания, удара, трения и тому под. способны «взрывать», то есть быстро разлагаться, превращаясь в накаленные сжатые газы, стремящиеся занять большой объем. Происходящие газы, встречая преграды, производят на них давление, результатом чего являются: передача части живой силы взрыва частям преграды, перелом ее и измельчение, а иногда и отбрасывание с запасом живой силы частей, оказавших наименьшее сопротивление. Таким свойством В. веществ пользуются во множестве случаев, напр. при проведении туннелей, уничтожении подводных камней, выработке рудников, для движения механизмов (газовых двигателей), бросания ракет, стрельбы, действия мин при защите берегов и т. п. Древние народы не знали В. веществ. Изучение их, начавшееся в XV столетии благодаря открытию пороха, бывшего ранее известным в Китае, имеет значение не только потому, что они оказывают множество услуг и часто сильно облегчают работу, действуя как молот, ударом, но даже и потому, что может предотвратить получение случайных взрывов и содействовать закономерному управлению силой взрывчатых веществ. Предлагаемая статья содержит сведения: I) о составе В. веществ; II) о разложении их при взрыве; III) о скорости взрывов; IV) о детонации; V) об объеме газов; VI) о количестве отделяющегося при взрывах тепла; VII) о температуре при взрывах; VIII) о давлениях, развиваемых В. веществами, и IX) о работе В. веществ [1]. I. Состав В. веществ. Между В. веществами известны твердые, жидкие тела и газы; напр. обыкновенный порох — твердое тело, нитроглицерин — жидкость, смесь светильного газа с воздухом — газ. 1) Если смешать между собой по возможности однородно, в известной пропорции, с одной стороны, тела, легко выделяющие при нагревании кислород, и с другой — тела горючие, способные через соединение с кислородом давать тепло и газообразные продукты, то получатся так называемые взрывчатые смеси, которые могут быть весьма разнообразны. Простейшая из таких смесей есть гремучий газ, составленный из 2 об. водорода и 1 об. кислорода; сообщение огня какой-либо точке этой смеси вызывает почти мгновенное ее сгорание, т. е. соединение взятых тел с образованием 2 об. водяного пара и отделением огромного количества тепла. Явление взрыва, наблюдаемое при воспламенении в закрытой оболочке, обусловливается собственно отделяющимся теплом: на счет его не только распространяется горение быстро от слоя к слою, но и происходит столь сильное нагревание водяного пара, что при взрыве в закрытой оболочке на стенки ее получается давление в 10 раз большее сравнительно с начальным давлением смеси. Так же точно содержится при зажигании смесь из 2 об. окиси углерода и 1 об. кислорода: она весьма быстро и с большим отделением тепла образует 2 об. углекислого газа, если его измерять после взрыва, приведя к начальной температуре и начальному давлению, при которых измерены начальные объемы. Вместо 1 об. кислорода на 2 об. водорода или на 2 об. окиси углерода можно было бы взять 4,8 об. воздуха, т. е. смеси из 1 об. кислорода и 3,8 азота, причем рядом с продуктами горения — водой и углекислотой — получился бы свободный азот, в сущности же произошли бы те же явления, хотя и с меньшей интенсивностью, вследствие затраты тепла на нагревание азота, не принимающего участия в самом горении. Но вода и углекислота образуются при горении всяких органических веществ, как содержащих углеводородные элементы, поэтому и смеси их паров с кислородом или воздухом должны содержаться подобно предыдущим. Действительно, газообразные углеводороды, напр. светильный газ, пары летучих соединений, напр. эфира, бензина и т. п., образуют с воздухом взрывчатые системы; так назыв. рудничный газ есть не что иное, как смесь болотного газа с воздухом. Пары сернистого углерода, брызги нефти, угольная и серная пыль, крупинки крахмала и т. п., смешанные с воздухом, также могут дать место взрывам. Если прибавим, что свободный кислород во многих из таких смесей может быть заменен газообразными химическими его соединениями, легко разлагающимися, напр. закисью азота, окисью азота и т. п., то разнообразие В. смесей газов еще увеличится; так, 2 об. водорода с 2 об. закиси азота, взрываясь, превращаются в 2 об. водяного пара и 2 об. азота; или 2 об. циана с 4 об. окиси азота дают при воспламенении 4 об. углекислоты и 2 об. азота. При искусственном образовании взрывчатых смесей стремятся, чтобы взятое количество кислорода или вещества, его содержащего, было достаточно для полного сжигания горючих элементов смеси, напр. водорода и углерода. Нахождение наивыгоднейшей пропорции смешения по объему делается, изображая состав участвующих в превращении тел химическими частичными формулами, а само превращение — уравнениями, так как относительные весовые количества тел, соответствующие таким формулам, занимают в газообразном состоянии при одинаковых температуре и давлении равные объемы, а именно в 2 раза больший объем, чем объем весовой единицы водорода, по отношению к которому выражаются веса всех частиц. Тогда уравнение, взятое так, чтобы весь водород превращался в воду, углерод в углекислый газ, сера в сернистый газ и т. п., прямо укажет, в какой именно пропорции следует произвести смешение; оно в то же время дает и объем продуктов горения. Напр.: СН4 [2 об., болот. газ (метан)] + 2O2 [4 об., кислород] = СО2 [2 об., углекислый газ] + 2H2O [4 об., водяной пар]; (С2Н5)2О [2 об., пары эфира] + 6О2 [12 об., кислород] = 4СО2[8 об., углекислый газ] + 5H2O [10 об., водяные пары]; CS2 [2 об., пары сероуглерода] + 3О2 [6 об., кислород] = СО2 [2 об., углекислый газ] + 2SO2 [4 об., сернистый газ]; Изображение взрывчатых превращений химическими равенствами представляет наглядно и многие другие их свойства, почему ими пользуются постоянно. Небольшое уклонение от наивыгоднейшей пропорции кислорода не уничтожает взрывчатости системы; оно только меняет состав продуктов, обусловливая появление в них или свободного кислорода (в случае его избытка), или продуктов неполного горения, напр. окиси углерода (в случае избытка горючего газа, содержащего углерод). Но, постепенно увеличивая уклонение как в одну, так и в другую сторону, мы дойдем до пределов, когда горение перестает распространяться само собой, и тогда явление взрыва не наблюдается; причина этого заключается в том, что при большом избытке одного из смешанных газов температура в слоях, окружающих место возбуждения горения, этим избытком сильно понижается и нагревание их не достигает точки воспламенения. Но все перечисленные газовые смеси не могут употребляться в роли собственно взрывчатых веществ по причине очень большого объема, занимаемого ими в обыкновенных условиях. Единственная, которая получила техническое применение, это — смесь светильного газа с воздухом, употребляемая для движения в газомоторах (см. Газовые двигатели). Конечно, можно было бы газообразные В. смеси, способные легко принимать жидкое состояние, напр. этилен C2H4 и закись азота N2O, посредством охлаждения и давления превратить в жидкие взрывчатые смешения, занимающие малый объем и подобные настоящим взрывчатым жидкостям; но проще взять как горючие, так и поддерживающие горение вещества, имеющие это состояние в обыкновенных условиях. Останавливаясь собственно на выборе жидкостей, поддерживающих горение, обращают на себя внимание главным образом две — азотноватый ангидрид NO2, кипящий при 26°, и дымящаяся азотная кислота HNO3, кипящая при 86°. И действительно, как с первым, так и с последним сжигающим деятелем может быть приготовлен ряд взрывчатых жидких смесей через растворение в них различных горючих соединений. Смешивая сернистый углерод CS2, бензол С6Н6 и т. п. с азотноватым ангидридом, получают панкластиты, открытые Турпеном, напр.: CS2 [сероуглерод] + 3NO2 [азотнов. ангидр.] = СО2 [углек. газ] + 2SO2 [сернис. газ] + 1,5N2 [азот]. Смешения дымящейся азотной кислоты с нитробензолом С6Н5NO2 и другими подобными соединениями представляют собой так наз. кислые В. вещества Шпренгеля: C6H5NO2 [нитробензол] + 5HNO3 [азотная кисл.] = 6СО2 [углек. газ] + 5H2O [вода] + 3N2 [азот]. При взрыве как тех, так и других имеет место не только выделение огромного количества тепла, но и большое увеличение объема системы; так, литр панкластита вышеприведенного состава весом около 1,28 кил. дает 601,6 литров газов при нормальных условиях. Но, кроме малого начального объема, эти смеси представляют преимущество, важное в технической практике, в том отношении, что могут легко приготовляться непосредственно перед самым взрывом из веществ невзрывчатых и потому безопасных при перевозке. Представителем твердых взрывчатых смесей служит обыкновенный порох. Горючие элементы в нем сера S и уголь С; сжигающий деятель — калийная селитра KNO3. Смешение, рассчитанное на полное сгорание, отвечает частичному составу 10KNO3 + 3S + 8С. При сообщении огня селитра выделяет азот N и кислород О, оставляя окись калия К2О; сера и уголь с кислородом превращаются в серный ангидрид SO3 и углекислоту СО2; окись калия, соединяясь с ними, дает твердые труднолетучие соли — сернокислую K2SO4 и углекислую K2СО3: 10KNO3 + 3S + 8С = 3K2SO4 + 2K2СО3 + 6CO2 + 5N2. Но обыкновенно приготовляются сорта пороха с меньшим содержанием селитры, так как этим способом для единицы веса удается достигнуть увеличения объема газов, развивающихся при взрыве, а равно осуществить и некоторые другие задачи, важные при употреблении для стрельбы; напр. состав (приближенный) охотничьего сорта выражается формулой 16KNO3 + 6S + 13С, артиллерийского 2KNO3 + S + 3С; причем, понятно, в вышеозначенных продуктах взрыва должны появиться также вещества, не вполне окисленные, а именно: в газообразных — окись углерода СО, а в твердых — сернистый калий K2S. Вместо калийной селитры можно взять другие азотнокислые соли, напр. NaNO3, NH4NO3, Ва(NO3)2 или бертолетову соль KClO3 и хлорно-калиевую соль KClO4. Кроме того, здесь могут применяться также марганцово-калиевая KMnO4 и двухромовокалиевая соли K2Cr2О7, перекиси и другие подобные вещества, легко выделяющие при нагревании кислород. Вместо угля (или также и серы), с другой стороны, можно употреблять различные твердые органические тела, напр. клетчатку, крахмал C6H10O5, тростниковый сахар С12Н22О11, парафин СnН2n+2, нафталин С10Н8, уксусно-натриевую соль — NaC2H3O2, синеродистые и железисто-синеродистые соли, напр. KCN, K4Fe(CN)6, Pb2Fe(CN)6, многие сернистые металлы, напр. CuS, Sb2S3 и др., так как все эти тела способны гореть в кислороде. Какую бы ни взяли смесь из перечисленных тел, везде получим в большей или меньшей мере В. вещества, потому что везде будут присутствовать тела, легко выделяющие много кислорода, и тела, дающие при своем горении газы. И в самом деле, в различное время было предложено много разнообразных смешений, подобных обыкновенному пороху, напр. саксифрагин — из Ва(NO3)2 (с незначительной примесью KNO3) и С; амидный порох — из NH4NO3, KNO3 и С; галлоксилин — из KNO3, С, древесных опилок и K4Ее(CN)6; порох Ожандра — из KClO3, K4Fe(CN)6 и C12H22O11 и т. п. Замена одних составных частей другими одинакового значения, хотя бы и в соответствующей пропорции, влечет за собой изменение в объеме газов и в количестве тепла. Возьмем, напр., вместо калийной селитры эквивалентные количества (т. е. выделяющие то же количество кислорода) других азотнокислых солей, при чем газообразные продукты взрыва получатся сходственные и при одном и том же количестве угля и серы ни объем газов, ни количество тепла приблизительно не изменятся. Но, если делать расчет на единицу веса пороха, влияние эквивалентов сжигающих деятелей тотчас выступает на первый план. Пусть замена сделана на Ba(NO3)2: так как эквивалент (частичный вес) KNO3 есть 101, а эквивалент Ва(NO3)2 (половина частичного веса) 130,5, то поэтому на одно и то же количество серы и угля для образования сходственных продуктов горения придется взять Ba(NO3)2 на 1/3 более, т е. общий вес новой смеси будет больше, а следовательно, единица веса ее даст и газов, и тепла меньше. Обратное получится при замене KNO3 на NaNO3, потому что эквивалент последней соли менее, а именно равен только 85, т. е. единица веса смеси с NaNO3 выделит и тепла, и газов больше. Пусть, далее, вместо KNO3 употреблена азотнокислая соль меди Cu(NO3)2: в то время как KNO3, NaNO3, Ba(NO3)2 превращаются при взрыве в K2O, Na2O, ВаО, образующие с СО2 и SO3 прочные соли, Cu(NO3)2 дает чистую медь, т. е. производит сжигание не только кислородом элементов азотной кислоты, но и кислородом, соединенным с самой медью; а следовательно, с KNO3 будут эквивалентны 5/12Cu(NO3)2, или эквивалент этой соли в пороховых смесях равен 78, и с рассматриваемой точки зрения она еще выгоднее, чем NaNO3. Но так как пороха с NaNO3 и Cu(NO3)2 гигроскопичны, то они и непригодны для дела. 2) Во взрывчатых смесях частицы тел горючих и тел, поддерживающих горение, существуют отдельно; оттого при образовании наиболее типических из них (газовых и твердых) обыкновенно не наблюдается никаких внешних явлений, указывающих на внутренние частичные работы; оттого же в твердых смесях, где частицы не обладают подвижностью, никогда нельзя достигнуть совершенной однородности состава. Но можно представить, что элементы горючие и сжигающий кислород (в достаточной пропорции) совмещены в одной и той же химической частице — в однородном химическом соединении; таковы, например, азотно-аммиачная соль NH4NO3, щавелевокислые соли серебра Ag2C2O4 и ртути HgC2O4, хлорнокислый СН3ClO4 и азотнокислый метил СН3NO3 и т. п. Все подобные соединения, обладая сравнительно малой устойчивостью, при сообщении огня стремятся превратиться в систему тел наиболее прочных, каковыми являются СО2, СО, H2O, HCl, N2, т. е. дают место как бы внутричастичному сгоранию, напр.: NH4NO3 = 2Н2О + N2 + О; Ag2C2O4 = 2СО2 + 2Ag и пр. Однородность состава обеспечивается здесь самим актом химического соединения. Нечто подобное в этом отношении может быть у взрывчатых растворов, которые потому составляют переход к настоящим взрывчатым химическим соединениям. Наибольшее число представителей рассматриваемых соединений относится к так называемым нитросочетаниям органических веществ, образующимся из элементов с выделением тепла. Как известно, многие углеродистые вещества при обработке азотной кислотой выменивают часть своего водорода на так называемую нитрогруппу (NO2). Смотря по натуре органических веществ, эта реакция ведет к образованию или азотных эфиров, или нитросоединений. а) Азотные эфиры, получающиеся при действии азотной кислоты на алкоголи и характеризующиеся способностью разлагаться кислотами и щелочами с возрождением первоначальных веществ, суть не что иное, как алкоголи, водный водород которых вполне или отчасти замещен нитрогруппами, а именно Rn(NO2O)n, где Rn изображает сложную группу атомов, в которой могут содержаться C, H и O. Очевидно, предельное число нитрогрупп, а вместе с тем и число паев кислорода, входящих в частицу эфира, будет условливаться атомностью (числом водных групп) данного алкоголя; от количества же кислорода находится в зависимости способность к более или менее совершенному внутричастичному сгоранию. Вследствие этого взрывчатые свойства обыкновенно являются наиболее развитыми в полных азотных эфирах многоатомных алкоголей. Таковы суть: эфиры глицерина С3Н5(NO3)3 (нитроглицерин), эритрита С4Н6(NO3)4 (нитроэритрит), маннита C6H8(NO3)6 (нитроманнит), различных углеводов, а именно — молочного сахара С12Н17О6(NO3)5 (пентанитросахароза), клетчатки С12Н14О4(NO3)6 (пироксилин) и др. б) Нитросоединения, отличающиеся от азотных эфиров по неспособности показывать чистые реакции распадения с образованием первоначальных веществ, представляются как органические вещества, в которых нитрогруппы замещают часть углеводородного водорода Rn(NO2)n. С особенной легкостью они получаются при действии азотной кислоты на тела т. н. ароматического ряда, напр. нитронафталин C10H7(NO2), бинитробензол С6Н4(NO2)2, тринитрофенол C6H2(NO2)3OH (пикриновая кислота), тринитрокрезол С6Н(СН3)(NO2)3OH и т. п. В практике, однако, редко употребляют указанные соединения в чистом состоянии. Так, нитроглицерин применяется в технике главн. образ. в виде смесей его с кремнеземом, называемых динамитами с недеятельным поглотителем; точно так же вместо чистого пироксилина чаще всего употребляют смеси его с водой в виде прессованных шашек под именем влажного пироксилина и т. п. Примешивание инертных веществ имеет целью или умерить силу взрывчатого действия, или сообщить массе безопасность при перевозке, хранении, приготовлении зарядов и пр. Но преимущественно посредством смешения с другими телами стараются поправить состав нитрированных веществ, который обусловливается химическими законами и в то же время далеко не всегда соответствует наивыгоднейшему отношению между количествами кислорода и горючих элементов. В самом деле, в азотных эфирах углеводов, во всех ароматических нитросоединениях содержание кислорода недостаточно для полного сгорания углерода и водорода; таковые, очевидно, полезно смешивать с селитрами и другими сжигающими деятелями. Некоторые из них по недостаточности кислорода совсем даже не могут быть употребляемы без прибавления окислителей. Отсюда происходят ряды новых взрывчатых смесей, отличающихся от вышерассмотренных тем, что горючие части в них сами по себе взрывчаты: напр. смеси пироксилина с KNO3, пикриновые пороха [смеси пикриновых солей C6H2(NO2)3OM с соответственными MNO3], смеси, содержащие нитроуглеводороды [C6H4(NO2)2, C10H7(NO2) с MNO3 или HNO3] и т. п. Наоборот, в нитроглицерине, нитроманните содержится избыток кислорода; таковые полезно смешивать с горючими веществами. Во взрывчатых смесях этого рода самостоятельная взрывчатость принадлежит сжигающему деятелю; сюда относятся многие динамиты с деятельным основанием, напр. целлюлозный динамит, в котором поглотителем нитроглицерина служит древесная масса. Но, очевидно, можно осуществить и такие смеси, в которых и горючие части, и сжигающий деятель будут вещества сами по себе взрывчатые; это, напр., имеет место в так назыв. студенистом динамите, или взрывчатом желатине, где нитроглицерин сопоставлен с пироксилином, а также в смесях нитросоединений с азотно-аммиачной солью. 3) Все вышерассмотренные вещества развивают и газы и теплоту вследствие горения. Но то и другое (газы и теплота) может получиться при простом распадении некоторых соединений, вследствие чего последние также являются веществами взрывчатыми. Таковы именно различные вещества, образованные из элементов с поглощением тепла (эндотермические) при содействии посторонней энергии, доставляемой чаще всего одновременным совершением какой-либо отделяющей тепло (экзотермической) реакции. Сюда относятся многие В. вещества, весьма интересные в химическом отношении, но практическим значением не обладающие: а) Простейшие соединения азота: хлористый азот NCl3, йодистый азот NHJ2, азотистая ртуть N2Hg3, сернистый азот NS и др. б) Окислы хлора — хлорноватистый ангидрид Cl2О, хлорноватая окись ClO2 и др. в) Некоторые соединения, разлагающиеся со взрывом с помощью небольшого количества воспламененной гремучей ртути, — ацетилен С2Н2, циан С2N2, окись азота NO, сернистый углерод CS2 и др. г) Диазосоединения, получающиеся при действии азотистой кислоты на разнообразные амидосоединения ароматического ряда. Сообщение огня приведенным соединениям производит простое распадение их на первоначальные элементы и освобождение тепла, поглощенного при их образовании. Так, хлористый азот (жидкость уд. в. 1,65), разлагается по уравнению: 2NCl3 = N2 + 3Cl2, и граммовая частица его (частичный вес, выраженный в граммах), равная 120,5 граммам, выделяет при этом 57,8 больших калорий, или 57800 малых калорий (Сен-Клер-Девилль и Готфейль «An. de Chim. et de Phys.», т. LXIX, p. 152). Явления поглощения тепла играют существенную роль и в вышерассмотренных нитрированных веществах. Легкая разлагаемость азотной кислоты и сильное сжигательное действие ее на углеродистые водороды зависят именно от того, что все кислородные соединения азота представляют собой соединения (эндотермические), образованные с поглощением тепла. 4) Наконец, ныне известны многие такие химические соединения, при взрыве которых будут иметь место одновременно оба выше установленных фактора взрывчатости: и распадение с освобождением поглощенной при их образовании энергии, и внутричастичное горение. Таковы, например, соли диазобензола — азотнокислая C6H5N2NO3, хромовокислая (С6Н5N2)2CrO4, гремучекислые соли ртути С2HgN2О2, серебра C2Ag2N2O2 и друг., так как при взрыве их углерод вполне или отчасти сгорает в окись углерода и в то же время все они образованы с поглощением тепла, ибо, относя теплоты образования из элементов к граммовым частицам, обозначая поглощение его знаком минус и выражая количества его в больших калориях (Кал.), Бертело и Вейль («Sur la forée des matières explosives d’après la Thermochimie» par Berthelot, т. II, p. 256 et 260) нашли: для гремучей ртути (284 грам.) — 62,9 Кал., для азотнокислого диазобензола (167 грам.) — 47,4 Кал. Таким образом, область В. веществ является довольно широкой. Их можно разделить на следующие группы: Группа I. Взрывчатые смеси, составленные из горючих и сжигающих веществ, самих по себе в отдельности не взрывчатых, а именно: 1-я подгруппа — газовые взрывчатые смеси. 2-я подгруппа — взрывчатые растворы. 3-я подгруппа — пороховые смеси (твердые), распределяющиеся, в свою очередь, по семействам соответственно натуре сжигающего деятеля. Группа II. Азотные эфиры: 1-я подгруппа — эфиры многоатомных алкоголей и их смеси. Относящиеся сюда нитроглицериновые препараты размещаются в семейства: а) динамиты с недеятельным основанием, б) динамиты с деятельным основанием, в) взрывчатые желатины. 2-я подгруппа — эфиры углеводов, из которых пироксилин с различными препаратами, его содержащими, образует отдельное семейство. Группа III. Нитросоединения: а) чистые (не смешанные с окислителями), напр. пикриновая кислота; б) смеси их с различными сжигающими деятелями, напр. пикриновые пороха, смеси нитроуглеводородов с NH4NO3 и др. Группа IV. Гремучие соли. Группа V. Взрывчатые диазосоединения. Группа VI. В. вещества, не содержащие в себе углерода: NH4NO3, NCl3, NHJ2 и др. Но далеко не все вещества, обладающие взрывчатостью, могут применяться в технике. Практика пользуется только такими из них, которых ценность сравнительно невелика, постоянство (неизменность) при хранении в разных климатах обеспечено, практическое получение не связано с затруднениями и опасностями. Столь же важны, кроме того, еще следующие условия: устойчивость при ударе, трении, сотрясении и тому подобных влияниях, могущих иметь место во время перевозки и употребления, способность взрывать, притом без отказа, только при определенном способе воспламенения и неуклонность в величине и характере взрывчатого действия. Пригодные для практического употребления В. вещества относятся главным образом к первым трем группам и отчасти к четвертой. В настоящее время преобладающее значение сосредоточивается особенно на порохе, нитроглицерине, динамитах и пироксилине (в различных его препаратах). Благодаря силе В. В. из нитроглицерина и пироксилина они вытесняют обыкновенный порох при производстве разнообразных взрывных работ. Порох продолжает еще держаться для производства метательных действий, но новейшие исследования, приведшие к открытию бездымного пороха, позволяют заключить, что и в этой области применений нитроглицерин и пироксилин в ближайшем будущем займут первенствующее место. II. Разложение В. веществ. Состав и тепловые явления при образовании из элементов, определяя взрывчатые свойства, не дают еще полных основ для более точной характеристики В. веществ; для этого необходимо знать также состав и тепловые явления при образовании продуктов взрыва, другими словами — должны быть известны уравнения их разложения. Обыкновенно для возбуждения разложения В. вещество (или некоторая его доля) должно быть нагрето до определенной температуры, которая называется температурой его воспламенения, напр. обыкновенный порох — до 270°, пироксилин и нитроглицерин — до 180° и пр. В действительности, однако, такие температуры представляют величины изменчивые в зависимости от быстроты нагревания; вообще же говоря, это — такие температуры, при которых происходит химическое превращение В. веществ в газы, составляющее сущность взрывов. Согласно разнообразным исследованиям, сюда относящимся, В. вещества вообще способны разлагаться по различным уравнениям в зависимости от условий возбуждения разложения. Первым В. веществом, хорошо исследованным в указанном отношении, был обыкновенный (черный, дымный) порох. Образцовое исследование его начато было Бунзеном с Шишковым и завершено Абелем и Ноблем. Но так как это есть механическая смесь, то здесь дело очень сложно и изменчиво. Поучительнее определенные В. вещества. Типическим примером может служить азотно-аммиачная соль H4NO3, которая, по Бертело, смотря по быстроте и степени нагревания, разлагается по крайней мере по 5 различным уравнениям, то с поглощением, то с большим или меньшим отделением тепла («An. de Chimie et de Phys.», 4-e série, t. XVIII, p. 68), а именно — считая все продукты разложения газообразными, а взятую соль твердой, относя теплоты разложения к граммовой частице (80 грам.) и обозначая выделение тепла (в отличие от поглощения) знаком плюс, могут иметь место следующие превращения:
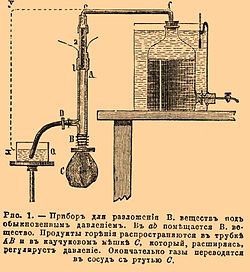
Первые три реакции происходят постепенно при осторожном нагревании соли до плавления и выше; из них преобладающая, по которой главным образом совершается разложение в этих условиях, есть вторая, т. е. та, которая применяется в лабораториях для получения закиси азота. Пятое уравнение, а также отчасти и четвертое соответствуют взрывчатому разложению, имеющему место при быстром и сильном нагревании, напр. при бросании нескольких кристалликов соли в докрасна накаленную стеклянную трубку. Подобную способность к разнообразному разложению В. вещества проявляют особенно вследствие неодинаковости местных условий, получающихся в массе, подвергнутой прогрессивному нагреванию, напр. в парафиновой ванне. Эти условия могут быть: или химические, напр. неоднородность смешения, изменение вещества предварительным менее значительным нагреванием; или физические, напр. температура, охлаждающие влияния, конденсация, испарение; или, наконец, механические, напр. давление, сотрясение и т. п. Такая же неодинаковость местных условий получается и при воспламенении В. веществ с помощью обыкновенных способов (см. Запалы), под малыми давлениями. Но если взятое вещество химически однородно по всей массе, как, напр., нитроглицерин, пироксилин, гремучая ртуть, если оно каким-либо способом сразу подвергнуто одинаковым условиям наиболее сильного нагревания во всех своих частях, то взрыв его дает продукты простые, наиболее прочные, и все разложение легко выражается одним уравнением. Такая простота разложения взрывчатых химических соединений замечается или при воспламенении их в прочных бомбах под высокими давлениями, или при взрывании с помощью капсюля с гремучей ртутью, вызывающего своим взрывом однообразные частичные расположения и состояния заряда. Только уравнения подобных правильных разложений является возможным предвидеть в настоящее время благодаря исследованиям Бертело, Сарро и Вьейля («Mémoriales des poudres et salpêtres», t. I. et II). Но дадим сначала краткое описание употребленных ими приборов. Для изучения разложений под давлениями, близкими к атмосферному, вещество (около 1 грамма) помещается в маленькую трубочку a b (см. рис. 1) около 50 мм длиной и 4 мм в диаметре, верхняя часть ее посредством каучуковой смычки е и стеклянной трубки f соединяется с бутылью, наполненной ртутью, а нижняя часть сообщается с каучуковым шаром C с помощью более широкой трубки AB (около 150 мм длиной), снабженной боковым каучуковым рукавом с зажимом D. Поместив зажимы в е и D, производят накаливание проволоки током в нижней части заряда; очевидно, что тогда разложение совершится, благодаря эластичности каучукового шара, под давлением, близким к атмосферному. Образующиеся газы переводятся в сосуд со ртутью, выпуская последнюю из крана и под конец погружая открытый конец каучукового рукава в чашку с водой, для того чтобы вытеснить остаток газов. Анализ газов, в этих условиях получающихся, и привел к вышеуказанному заключению о разнообразии и сложности их состава. Вследствие местных охлаждений реакции не доходят до конца, и получаются продукты, способные еще к дальнейшему взаимодействию с отделением значительных количеств тепла. Так, для нитроглицерина (в динамите) найдены были CO2, СО, Н2, СН4, N2 и NO; для пироксилина — СО2, СО, Н2, СН4, N2, NO; для смеси пироксилина с азотно-аммиачной солью в пропорции для полного горения — СО2, СО, Н2, N2, NO. Количества окиси азота во всех случаях получились большие, а следовательно, много кислорода действительно осталось не употребленным на горение. Для исследования разложений под высокими давлениями служили бомбы, употребляемые для определения количеств отделяющегося при взрыве тепла (калориметрическая) и для измерения давлений газов (манометрическая). Получающаяся при взрыве вода остается в бомбе вместе с твердыми продуктами, откуда может быть извлечена в поглотительные приборы (трубки с хлористым кальцием) и в последних дозирована. Для этого стоит только, поставив бомбу в баню при 100°, пропускать в нее воздух, вводя его по трубке, вставленной в отверстие для запального приспособления и проводя далее в поглотительные приборы. Для выпускания газов в калориметрической бомбе имеется специальный кран В с очень тонкой винтовой нарезкой снаружи и каналом по оси; нижняя коническая часть его притерта к отверстию в крышке. 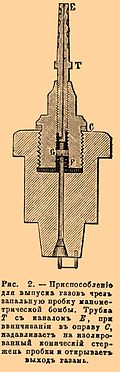 Рис. 2. Приспособление для выпуска газов через запальную… Продолжение »
|
Взры́вчатое вещество́ (ВВ) — химическое соединение или их смесь, способное в результате определённых внешних воздействий или внутренних процессов взрываться, выделяя тепло и образуя сильно нагретые газы. Комплекс процессов который происходит в таком веществе, называется детонацией. Традиционно к взрывчатым веществам также относят соединения и смеси, которые не детонируют, а горят с определенной скоростью (метательные пороха, пиротехнические составы). Существует ряд веществ, также способных к взрыву (например, ядерные и термоядерные материалы, антивещество). Также существуют методы воздействия на различные вещества, приводящие к взрыву (например, лазером или электрической дугой). Обычно такие вещества не называют «взрывчатыми». |